Особенности работы ФГИС МДЛП в период уведомительного
режима функционирования системы
Ввиду вступления в силу постановления Правительства Российской Федерации №1779 от 02.11.2020 (далее – ППРФ №1779) участниками оборота на временный период может применяться упрощенный режим передачи сведений о движении лекарственных препаратов в ФГИС МДЛП (далее – уведомительный режим).
До 1 февраля 2021г., в случае неполучения субъектом обращения лекарственных средств квитанции о приеме сведений в соответствии с абзацем вторым настоящего пункта при представлении сведений в систему мониторинга в соответствии с абзацем третьим пункта 35, пунктами 37 - 381, 40, 41, 43, 44, 442 и 45 настоящего Положения в течение 15 минут с момента представления субъект обращения лекарственных средств вправе осуществлять дальнейшие операции с лекарственными препаратами, не дожидаясь получения квитанции о приеме сведений.
Указанная норма распространяется на случаи:
• отсутствия сформированной ФГИС МДЛП квитанции при обработке и фиксации в ФГИС МДЛП сведений, представленных субъектом обращения лекарственных средств;
• формирования ФГИС МДЛП квитанции с ошибкой (Reject) по итогам обработки сведений, представленных субъектом обращения лекарственных средств;
• формирования ФГИС МДЛП квитанции с частичным приемом сведений (Partial);
• нештатной работы ФГИС МДЛП, блокирующей прием сведений от субъектов обращения лекарственных средств, подтвержденной оператором ФГИС МДЛП;
• недоступность портала или API ФГИС МДЛП.
Для работы в уведомительном режиме Оператором МДЛП разработаны следующие схемы логической модели файлов обмена:
• Схема 702 – Регистрация в ФГИС МДЛП сведений об оприходовании.
• Схема 703 – Регистрация в ФГИС МДЛП сведений об оприходовании (импорт).
Для лекарственных препаратов, сведения о которых представлены субъектом обращения в Росздравнадзор перед вводом в гражданский оборот или в отношении которых Росздравнадзором выдано разрешение на ввод в гражданский оборот (для иммунобиологических лекарственных препаратов) до 1 февраля 2021 года, сохраняется уведомительный режим до истечения срока их годности. Их можно передавать покупателю сразу, не дожидаясь ответа системы маркировки.
Узнать, когда лекарство было введено в гражданский оборот, можно по серийному номеру препарата (указан в реестре сертификатов или на упаковке препарата):
1. Электронный сервис Росздравнадзора «Сведения о лекарственных средствах, вводимых в гражданский оборот в Российской Федерации»:
-
вводим в строку поиска серию препарата:
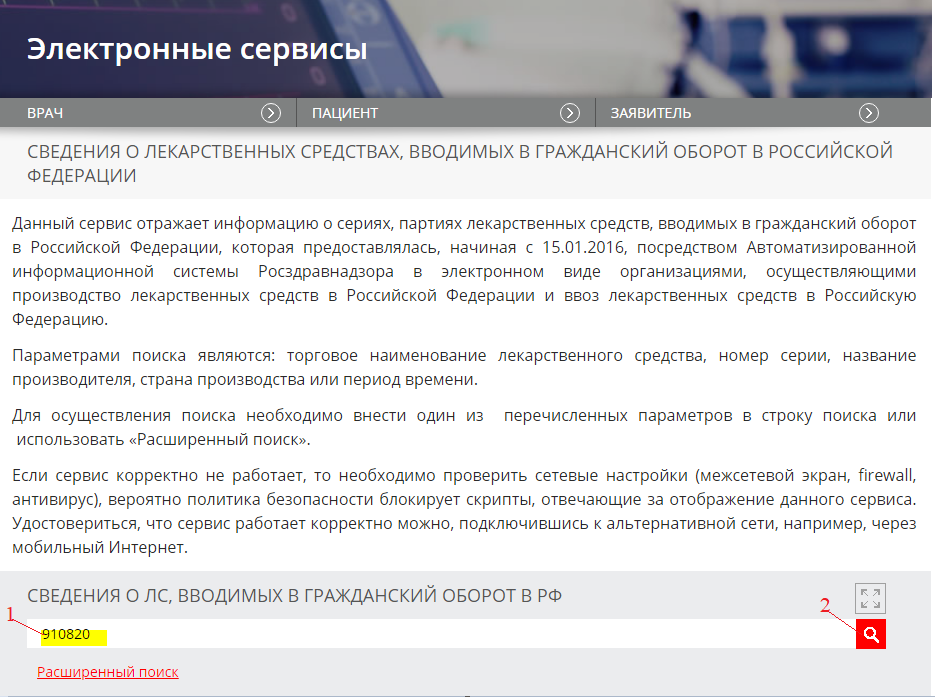
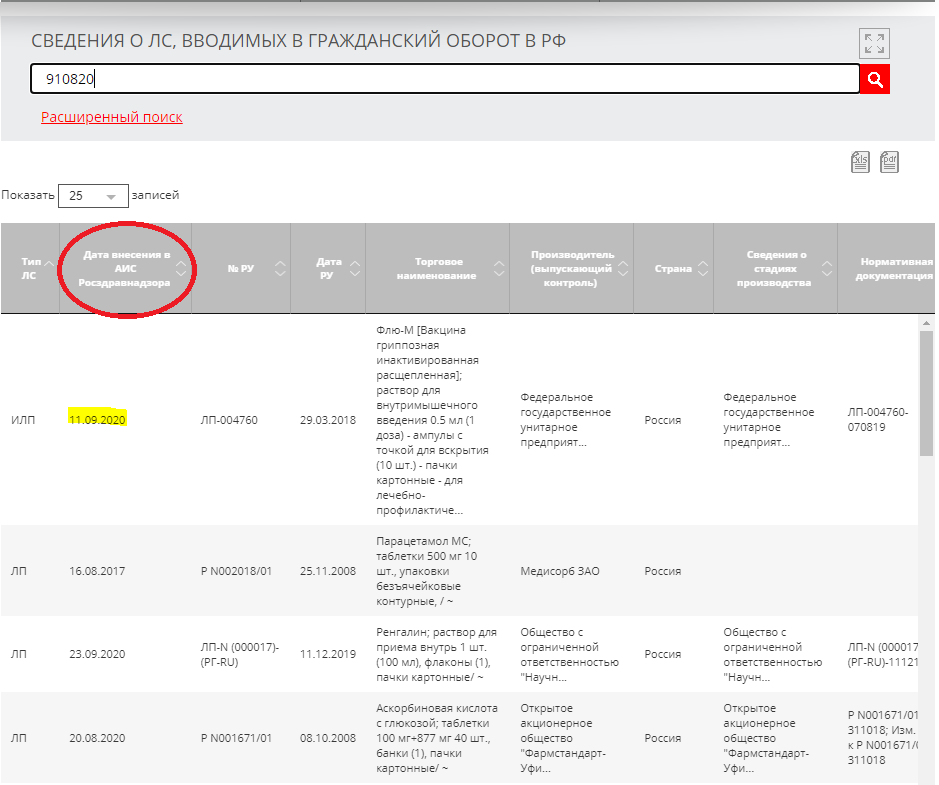
-
В результатах поиска найдите препарат и посмотрите дату ввода в гражданский оборот в столбце «Дата внесения в АИС Росздравнадзора».
Если результатова по серии много, кликните «Расширенный поиск» и укажите дополнительные сведения о препарате, например торговое наименование или производителя.
2. Метод API «8.14.1. Фильтрация по реестру решений о вводе лекарственных препаратов в гражданский оборот» ФГИС МДЛП. В отношении лекарственных препаратов, производство которых осуществляется вне территории Российской Федерации и ввоз которых в Российскую Федерацию осуществляется отдельными партиями, возможность сохранения уведомительного режима определяется по наиболее ранней дате (дате представления сведений в АИС 16 Росздравнадзора или выдачи разрешения Росздравнадзором о первой ввозимой партии из серии лекарственного препарата).
